Lonza Amaxa 4D-Nucleofector細(xì)胞核轉(zhuǎn)染系統(tǒng)
——哺乳動物真核細(xì)胞高效基因轉(zhuǎn)染

德國進(jìn)口Lonza 4D-Nucleofector細(xì)胞核轉(zhuǎn)染系統(tǒng)(原Amaxa 4D-Nucleofector核轉(zhuǎn)儀),創(chuàng)新性地結(jié)合經(jīng)典電穿孔技術(shù)和細(xì)胞特異性電轉(zhuǎn)染液,實現(xiàn)了DNA、RNA(如crRNA、tracrRNA、gRNA、sgRNA)、RNP核糖核蛋白復(fù)合體、蛋白質(zhì)(如Cas9核酸酶、切口酶、dCas9蛋白、Cas12a/Cpf1核酸酶)、小分子物質(zhì)高效轉(zhuǎn)染各類哺乳動物貼壁細(xì)胞、懸浮細(xì)胞、外泌體exosome等。
新款Lonza 4D核轉(zhuǎn)儀由用于小規(guī)模轉(zhuǎn)染的X模塊(4D-Nucleofector X Unit)、貼壁細(xì)胞不經(jīng)消化進(jìn)行原位轉(zhuǎn)染的Y模塊(4D-Nucleofector Y Unit)、單一細(xì)胞大規(guī)模流式轉(zhuǎn)染的LV模塊(4D-Nucleofector LV Unit)、高通量篩選的96孔模塊(原96-well Shuttle Device)組成。 點擊查看:Lonza Nucleofector 2B Device 單孔核轉(zhuǎn)儀2B型號
Lonza 4D-Nucleofector技術(shù)不依賴于細(xì)胞有絲分|裂,不受細(xì)胞增殖的影響,可直接將外源基因?qū)爰?xì)胞核中,即使是未分|裂的原代細(xì)胞(如靜止的T淋巴細(xì)胞或神經(jīng)元),也可以快速表達(dá)。
Lonza 4D-Nucleofector對質(zhì)粒DNA轉(zhuǎn)染效率高達(dá)90%,寡核苷酸(如siRNA)轉(zhuǎn)染效率高達(dá)99%,面世20年來,已成功轉(zhuǎn)染>1200種細(xì)胞系、>130種原代細(xì)胞,并在干細(xì)胞、免疫細(xì)胞、神經(jīng)細(xì)胞等各類較難轉(zhuǎn)染的細(xì)胞、以及外泌體電穿孔裝載藥物中獲得了優(yōu)秀的效果。
由于同種細(xì)胞系或原代細(xì)胞使用相同的轉(zhuǎn)染條件(轉(zhuǎn)染程序和轉(zhuǎn)染試劑盒),Lonza 4D-Nucleofector可實現(xiàn)多種外源物質(zhì)共轉(zhuǎn)染,例如CRISPR-Cas9基因編輯時共轉(zhuǎn)染2種sgRNA等。
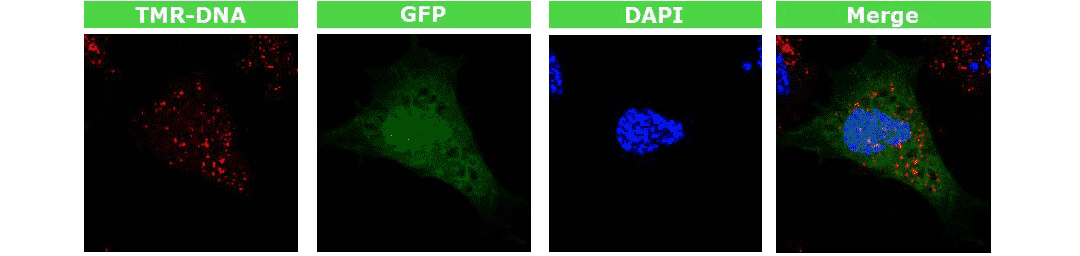
圖. GFP標(biāo)記的質(zhì)粒轉(zhuǎn)染新生兒皮膚成纖維細(xì)胞,2小時后用3.5% PFA 固定,共聚焦顯微鏡可觀察到GFP蛋白在細(xì)胞核內(nèi)表達(dá)。
4D-Nucleofector細(xì)胞核轉(zhuǎn)染方法特點
1.針對每種細(xì)胞優(yōu)化的電脈沖參數(shù),可將底物導(dǎo)入細(xì)胞質(zhì)甚至是細(xì)胞核;
2.特殊配方的電轉(zhuǎn)染液,同時提供高轉(zhuǎn)染效率和細(xì)胞保護(hù),提高細(xì)胞轉(zhuǎn)染后存活率;
3.全球共享數(shù)據(jù)庫,專業(yè)指導(dǎo),從細(xì)胞來源、傳代、培養(yǎng)條件、培養(yǎng)基、轉(zhuǎn)染程序選擇和操作技巧、到轉(zhuǎn)染后培養(yǎng)技巧,已形成成熟的實驗方案。
4D-Nucleofector核轉(zhuǎn)染系統(tǒng)為基因治療研究、免疫治療研究、干細(xì)胞研究等提供了方便的工具。相比電穿孔在內(nèi)的其他非病毒轉(zhuǎn)染技術(shù),更具優(yōu)勢:
-采用高分子聚合物電極,避免傳統(tǒng)鋁電極的離子毒害,維持細(xì)胞生理狀態(tài),提高存活率。
-轉(zhuǎn)染后可快速觀察實驗結(jié)果,例如轉(zhuǎn)染GFP后最快2小時可觀察到蛋白。
-無需自己優(yōu)化條件,擁有超過759種細(xì)胞類型的現(xiàn)成程序,可直接使用,全球共享數(shù)據(jù)庫,超過1500條轉(zhuǎn)染數(shù)據(jù)可供參考,并持續(xù)更新。
-可轉(zhuǎn)染包括DNA、mRNA、miRNA、siRNA、RNP、肽、蛋白質(zhì)、小分子化合物在內(nèi)的多種底物。
-可用于難以轉(zhuǎn)染的原代細(xì)胞、干細(xì)胞、神經(jīng)元、細(xì)胞系,以及外泌體
-可不用消化細(xì)胞,進(jìn)行貼壁細(xì)胞的原位轉(zhuǎn)染。
-靈活的轉(zhuǎn)染規(guī)模縮放,可在低、中、高通量中輕松轉(zhuǎn)移,實現(xiàn)2×10^4至1×10^9個細(xì)胞數(shù)量的輕松擴(kuò)展。
-全球發(fā)表文章超過14,000篇。
最近,Lonza 4D-Nucleofector核轉(zhuǎn)染系統(tǒng)已廣泛應(yīng)用于通過RNAi、CRISPR-Cas9、CRISPR-Cas12a進(jìn)行的基因敲除研究、以及iPS誘導(dǎo)多能干細(xì)胞、CAR-NK、CAR-T、外泌體藥物遞送的研究中,在包括功能和結(jié)構(gòu)基因組學(xué)、藥物發(fā)現(xiàn)以及基因和細(xì)胞療法的研究中大放異彩。
4D核轉(zhuǎn)儀結(jié)構(gòu)和功能應(yīng)用:
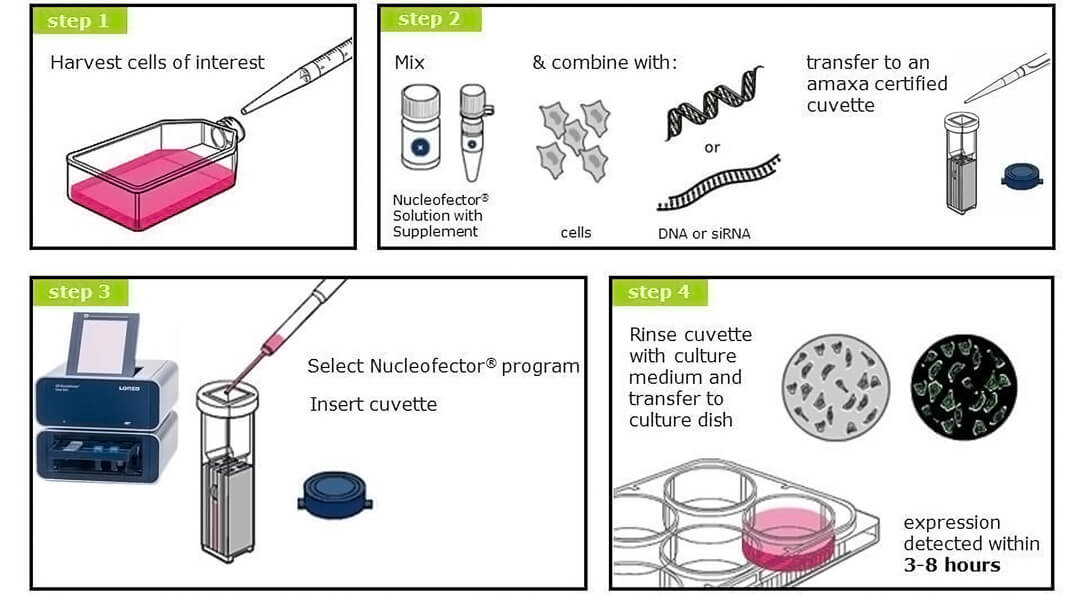
4D-Nucleofector細(xì)胞核轉(zhuǎn)染系統(tǒng)采用模塊化設(shè)計,可根據(jù)研究者的需求,自行組合數(shù)個模塊形成一套完整系統(tǒng)。
1、C模塊:4D-Nucleofector系統(tǒng)的控制單元,內(nèi)置轉(zhuǎn)染程序,將不同的功能單元(模塊)整合為一個系統(tǒng),以運行不同的應(yīng)用程序。

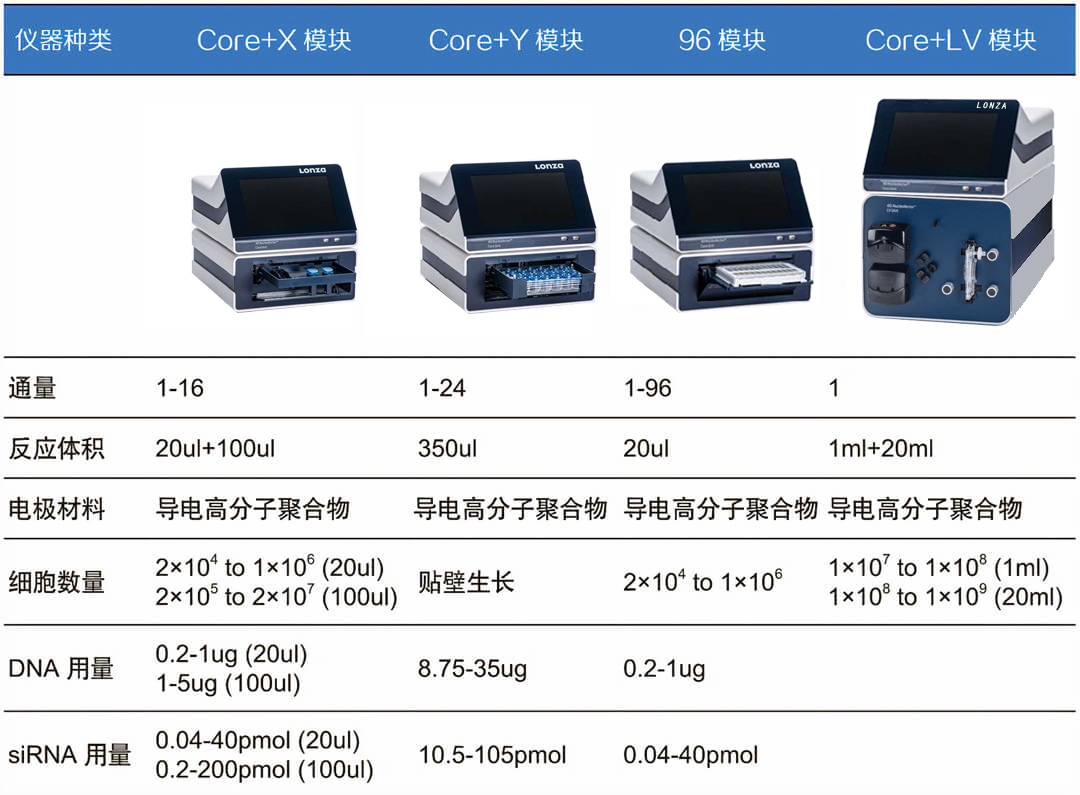
2、X模塊:用于懸浮細(xì)胞、或貼壁細(xì)胞消化后的小規(guī)模轉(zhuǎn)染,轉(zhuǎn)染細(xì)胞數(shù)量2×10^4至2×10^7。可同時轉(zhuǎn)染2個100μL電轉(zhuǎn)杯、1個16孔電轉(zhuǎn)板條(每孔20μL),每個電轉(zhuǎn)杯、每個孔可獨立設(shè)置程序。另外在使用96孔模塊時,也需要X模塊。

3、Y模塊:用于貼壁細(xì)胞不經(jīng)消化的原位轉(zhuǎn)染,可同時轉(zhuǎn)染1個24孔電轉(zhuǎn)板條(每孔350μL),每個孔可獨立設(shè)置程序。

4、LV模塊:用于同一種懸浮細(xì)胞、或同一種貼壁細(xì)胞消化后的大規(guī)模轉(zhuǎn)染,轉(zhuǎn)染細(xì)胞數(shù)量1×10^7至2×10^9。可使用1mL手動進(jìn)樣電轉(zhuǎn)盤、或20mL連續(xù)進(jìn)樣電轉(zhuǎn)盤。通常使用X模塊小試摸條件,再用LV模塊線性放大轉(zhuǎn)染規(guī)模。

5、96孔模塊:用于同時轉(zhuǎn)染96個樣品的細(xì)胞,轉(zhuǎn)染細(xì)胞數(shù)量2×10^4至1×10^6。每個孔可獨立設(shè)置程序。必須與X模塊結(jié)合使用。

注:常用模塊組合參考
常規(guī)小規(guī)模轉(zhuǎn)染:C+X
貼壁細(xì)胞原位轉(zhuǎn)染:C+Y
懸浮+貼壁細(xì)胞轉(zhuǎn)染:C+X+Y
大規(guī)模轉(zhuǎn)染:C+X+LV
摸索復(fù)雜轉(zhuǎn)染條件:C+X+96孔
Lonza 4D-Nucleofector細(xì)胞核轉(zhuǎn)染系統(tǒng)參數(shù)
| 品牌 |
Lonza龍沙 |
| 產(chǎn)地 |
德國科隆 |
| 名稱 |
4D-Nucleofector細(xì)胞核轉(zhuǎn)染系統(tǒng) |
| 型號 |
4D |
| 貨號 |
AAF-1003B |
Core模塊,簡稱C模塊 |
| |
AAF-1003X |
X模塊 |
| |
AAF-1003Y |
Y模塊 |
| |
AAF-1002L |
LV模塊 |
| |
AAM-1003S |
96孔模塊 |
| 用途 |
用于干細(xì)胞、原代細(xì)胞、細(xì)胞系的高效轉(zhuǎn)染 |
| 適用細(xì)胞 |
貼壁細(xì)胞、懸浮細(xì)胞,包括難轉(zhuǎn)染的血液系統(tǒng)細(xì)胞和干細(xì)胞,外泌體 |
| 轉(zhuǎn)染物 |
質(zhì)粒、DNA、RNA、RNP、蛋白質(zhì)、小分子化合物等 |
| 銷售授權(quán) |
中國大陸一級代理(不含港澳臺) |
| 價格 |
詢價 |
| 貨期 |
C+X國內(nèi)現(xiàn)貨1周 |
| C+LV國內(nèi)現(xiàn)貨1周 |
| 其他型號4-6周 |
| 服務(wù) |
售前技術(shù)咨詢,裝機(jī),售后服務(wù)(售后限北京澤平銷售儀器) |
引用文獻(xiàn):
1.Synchronous Disintegration of Ferroptosis Defense Axis via Engineered Exosome-Conjugated Magnetic Nanoparticles for Glioblastoma Therapy. Boyan Li, et al. Advanced Science, May 4, 2022
2.Mouse brain-wide transgene expression by systemic injection of genetically engineered exosomes: CAP-Exosomes. Saumyendra N Sarkar, Debora Corbin, James W Simpkins. bioRxiv, April 9, 2022
3.Engineering of CRISPR-Cas12b for human genome editing.Strecker J, et al. Nature (2019) 10(1): 212
4.Gene correction for SCID-X1 in long-term hematopoietic stem cells.Pavel-Dinu M, et al. Nat Commun. (2019) 10 (1): 1634
5.Orthotopic replacement of T-cell receptor a- and ?-chains with preservation of near-physiological T-cell function.Schober K, et al. Nat Biomed Eng (2019) 10: 01
6.Ribonucleoprotein Transfection for CRISPR/Cas9-Mediated Gene Knockout in Primary T Cells.Oh SA, et al. Curr Protoc Immunol (2019) 124(1): e69
7.Polymer-stabilized Cas9 nanoparticles and modified repair templates increase genome editing efficiency.Nguyen DN, et al. Nat Biotechnol (2019) 1: 1
8.CRISPR-Cas9 genome engineering of primary CD4+ T cells for the interrogation of HIV-host factor interactions. Hultquist JF, et al. Nat Protocols (2019) 14(1): 1-27
9.Bacteria-free minicircle DNA system to generate integration-free CAR-T cells.Chen Cheng, et al. J Med Genetics (2019) 56: 10–17
10.Genome-wide CRISPR Screens in Primary Human T Cells Reveal Key Regulators of Immune Function. Shifrut E, et al. Cell (2018) 175(7): 1985-1971
11.Guide Swap enables genome-scale pooled CRISPR-Cas9 screening in human primary cells. Ting PY, et al. Nat Methods (2018) 15(11)
12.Cytokines induced killer cells produced in good manufacturing practices conditions: identification of the most advantageous and safest expansion method in terms of viability, cellular growth and identity.Castiglia S,et al.J Transl Med (2018) 16: 237
13.A high-fidelity Cas9 mutant delivered as a ribonucleoprotein complex enables efficient gene editing in human hematopoietic stem and progenitor cells. Vakulskas CA,et al.Nat Med (2018) 24(8): 1216-1224
14.Reprogramming human T cell function and specificity with non-viral genome targeting.Roth TL,et al.Nature (2018) 559: 405-9
15.Nucleofection with Plasmid DNA for CRISPR/Cas9-Mediated Inactivation of Programmed Cell Death Protein 1 in CD133-Specific CAR T Cells.Hu B,et al.Hum Gene Ther (2018)
16.Optimized RNP transfection for highly efficient CRISPR/Cas9-mediated gene knockout in primary T cells.Seki A,et al.J Exp Med (2018) 215(3): 985-997
17.Improved Expansion and In Vivo Function of Patient T Cells by a Serum-free Medium.Medvec AR,et al.Mol Ther Methods Clin Dev. (2017) 7; 8: 65-74
18.Going non-viral: the Sleeping Beauty transposon system breaks on through to the clinical side.Hudecek M1,et al.Clin Exp Immunol (2017) 52(4): 355(80)
19.CRISPR-Mediated Integration of Large Gene Cassettes Using AAV Donor Vectors.Bak RO,et al.Cell Rep (2017) 20(3): 750-756
20.CRISPR-Cas9 mediated LAG-3 disruption in CAR-T cells.Zhang Y,et al.Frontiers in Immunology (2017) 1: 1-9
21.CRISPR/Cas9-mediated PD-1 disruption enhances anti-tumor efficacy of human chimeric antigen receptor T cells.Rupp LJ1,et al.Scientific Reports (2017) 7 (1): 737
22.A genome-wide CRISPR screen identifies a restricted set of HIV host dependency factors.Park RJ, et al.Nat Genet (2017) 49(2): 193-203
4D-Nucleofector細(xì)胞核轉(zhuǎn)系統(tǒng)轉(zhuǎn)染RNP引用文獻(xiàn)
1. Seki A, Rutz S. Optimized RNP transfection for highly efficient CRISPR/Cas9-mediated gene knockout in primary T cells. J Exp Med. 2018 Mar 5;215(3):985-997. doi: 10.1084/jem.20171626. Epub 2018 Feb 7. PMID: 29436394; PMCID: PMC5839763.
2. Oh SA, Seki A, Rutz S. Ribonucleoprotein Transfection for CRISPR/Cas9-Mediated Gene Knockout in Primary T Cells. Curr Protoc Immunol. 2019 Feb;124(1):e69. doi: 10.1002/cpim.69. Epub 2018 Oct 18. PMID: 30334617.
3. Naeimi Kararoudi M, Dolatshad H, Trikha P, Hussain SA, Elmas E, Foltz JA, Moseman JE, Thakkar A, Nakkula RJ, Lamb M, Chakravarti N, McLaughlin KJ, Lee DA. Generation of Knock-out Primary and Expanded Human NK Cells Using Cas9 Ribonucleoproteins. J Vis Exp. 2018 Jun 14;(136):58237. doi: 10.3791/58237. PMID: 29985369; PMCID: PMC6101749.
4. Farboud B, Jarvis E, Roth TL, Shin J, Corn JE, Marson A, Meyer BJ, Patel NH, Hochstrasser ML. Enhanced Genome Editing with Cas9 Ribonucleoprotein in Diverse Cells and Organisms. J Vis Exp. 2018 May 25;(135):57350. doi: 10.3791/57350. PMID: 29889198; PMCID: PMC6101420.
5. Dewari PS, Southgate B, Mccarten K, Monogarov G, O'Duibhir E, Quinn N, Tyrer A, Leitner MC, Plumb C, Kalantzaki M, Blin C, Finch R, Bressan RB, Morrison G, Jacobi AM, Behlke MA, von Kriegsheim A, Tomlinson S, Krijgsveld J, Pollard SM. An efficient and scalable pipeline for epitope tagging in mammalian stem cells using Cas9 ribonucleoprotein. Elife. 2018 Apr 11;7:e35069. doi: 10.7554/eLife.35069. PMID: 29638216; PMCID: PMC5947990.
6. Daniel P. Dever1, Rasmus O. Bak1, Andreas Reinisch2, Joab Camarena1, Gabriel Washington1, Carmencita E. Nicolas1,
Mara Pavel-Dinu1, Nivi Saxena1, Alec B. Wilkens1, Sruthi Mantri1, Nobuko Uchida3, Ayal Hendel1, Anupama Narla4,
Ravindra Majeti2, Kenneth I. Weinberg1 & Matthew H. Porteus1. CRISPR/Cas9 β-globin gene targeting in human haematopoietic stem cells.2016 Springer Nature doi:10.1038 (使用4D-Nucleofector LV大規(guī)模流式核轉(zhuǎn)染系統(tǒng)轉(zhuǎn)染RNP)
北京澤平自2009年起至2024年連續(xù)16年作為Lonza中國一級代理商,長期穩(wěn)定銷售Lonza全系列產(chǎn)品,包括4D-Nucleofector核轉(zhuǎn)儀和核轉(zhuǎn)試劑盒、X-VIVO無血清培養(yǎng)基、人原代細(xì)胞和原代培養(yǎng)基、GS基因表達(dá)系統(tǒng)用CHO細(xì)胞培養(yǎng)基和補(bǔ)料、COCOON全封閉自動化細(xì)胞生產(chǎn)平臺、支原體檢測試劑盒和儀器、內(nèi)毒素檢測試劑盒和酶標(biāo)儀、瓊脂糖和閃膠、MODA實驗室管理系統(tǒng)等,在中國大陸地區(qū)多年的市場推廣中,憑借誠信經(jīng)營、專業(yè)服務(wù),贏得了眾多高校、科研院所、生產(chǎn)企業(yè)研究人員的認(rèn)可,并作為Lonza中國地區(qū)重要合作伙伴,多次獲得嘉獎。
①Lonza官方授權(quán),完整進(jìn)口手續(xù),正品保證
②專業(yè)技術(shù)支持團(tuán)隊,中文咨詢服務(wù),解決實驗問題
③完善銷售流程,售前、售后服務(wù)
④中國地區(qū)一級代理商,優(yōu)勢價格,貨源更充足,熱銷品現(xiàn)貨銷售
點擊右側(cè)在線咨詢,免費咨詢4D-Nucleofector核轉(zhuǎn)染系統(tǒng)技術(shù)問題+獲取報價+申請試用
——Lonza中國一級代理商,北京澤平
相關(guān)產(chǎn)品
Lonza 4D-Nucleofector LV大規(guī)模流式細(xì)胞核轉(zhuǎn)染系統(tǒng)
Lonza 2B細(xì)胞核轉(zhuǎn)染系統(tǒng)
Lonza 4D/2b-Nucleofector 細(xì)胞核轉(zhuǎn)染試劑盒
Lonza X-VIVO無血清培養(yǎng)基、干細(xì)胞培養(yǎng)基、原代細(xì)胞培養(yǎng)基、常規(guī)培養(yǎng)基
Lonza 人原代細(xì)胞
Lonza 支原體檢測、清除、預(yù)防試劑盒、Lucetta 2發(fā)光檢測儀
Lonza 內(nèi)毒素檢測試劑盒/鱟試劑、內(nèi)毒素專用酶標(biāo)儀、專用檢測軟件
Lonza 瓊脂糖、FlashGel閃膠系統(tǒng)
Lonza Moda 實驗室管理系統(tǒng)(微生物QC、制藥企業(yè)專用版)
IDT Alt-R CRISPR-Cas9基因編輯系統(tǒng)
IDT Alt-R CRISPR-Cas12a/Cpf1基因編輯系統(tǒng)